Doğada hidrojen tek başına bulunmayıp, birincil enerji kaynaklarından kullanılarak elde edilen bir enerji kaynağı çeşididir. Sınırlı rezerve sahip olan kömür ve doğal gaz gibi fosil kökenli enerji kaynakları, hidrojen üretiminde birincil enerji kaynağı olarak kullanılması durumunda çevreye büyük zararlar vermektedir. Bu sebepten dolayı suyun kullanılması ile hidrojen elde edilmesi temiz ve çevreci bir yol olmaktadır. Elektrolizörler kullanılan elektrolitin özelliğine göre sınıflandırılmaktadır. Sıvı elektrolit yaygın olarak alkali elektrolizörlerde, katı elektrolit ise genellikle Proton Elektrolit Membranlı (PEM) ve katı-oksit elektrolizörlerde kullanılmaktadır [1].
Alkali ve PEM elektrolizörler en gelişmiş ve hâlihazırda ticari olarak üretimi gerçekleşen elektrolizörlerdir. Alkali elektrolizörler en düşük kurulum maliyetine sahipken, PEM elektrolizörleri daha yüksek akım yoğunluğu ve çıkış basıncı ile birlikte daha çok hızlı başlama ve farklı güç talepleri gerektiren yerlerde hızlı yanıtlar sağlayabilmektedir. PEM elektrolizörlerler yüksek enerji yoğunluğuna sahip olduğu için diğer elektrolizörler tiplerine göre daha avantajlı konumdadır. PEM elektrolizörler ile suyun elektrolizi sağlanarak hidrojenin temiz, çevreci ve verimli bir şekilde üretimi gerçekleştirilmektedir. Suyun elektrolizi yönteminde temel olarak su elektrik akımı yardımıyla katot tarafından çıkan hidrojene ve anot tarafından çıkan oksijene ayrışmaktadır.
Şekil 1’de PEM elektrolizörün çalışma prensibi gösterilmiştir. PEM elektrolizörde anot tarafından verilen su anot katalizör tabakasında oksijen gazı, hidrojen iyonları ve hidrojenin elektronlarına ayrışmaktadır. Oksijen gazı anot tarafından hücre dışına alınırken, hidrojen iyonları (H+) membran üzerinden katoda geçmektedir. Elektronlar ise dış devre üzerinden katoda geçerek katot katalizör tabakasında hidrojen iyonları ile birleşerek hidrojen gazını oluşturmaktadır [1].
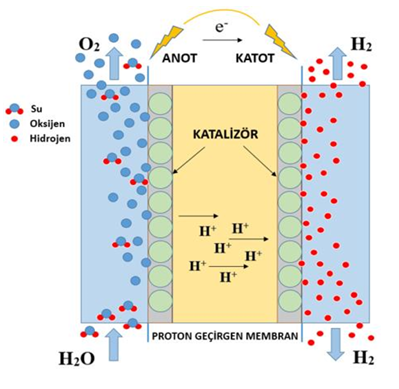
Şekil 1. PEM elektrolizör hücresinin çalışma prensibi [1].
PEM elektrolizörlerde hidrojen ve oksijen üretimi esnasında gerçekleşen anot, katot ve toplam reaksiyon şu şekildedir;
Anot reaksiyonu: 2H2O → O2+ 4H+ + 4e-
Katot reaksiyonu: 4H+ + 4e- → 2H2
Toplam reaksiyon: H2O → H2+1/2O2
Kaynaklar
[1] Genç, Ö., & Kallioğlu, M. A. (2018, January 31). PROTON ELEKTROLİT MEMBRANLI (PEM) ELEKTROLİZÖRÜN SAYISAL İNCELENMESİ VE DENEYSEL DOĞRULANMASI. Niğde Ömer Halisdemir Üniversitesi Mühendislik Bilimleri Dergisi; Association of Food Technology, Turkey. https://doi.org/10.28948/ngumuh.387154
[2] Hydrogen. (2023). https://www.lenntech.com.tr/applications/hydrogen.htm

